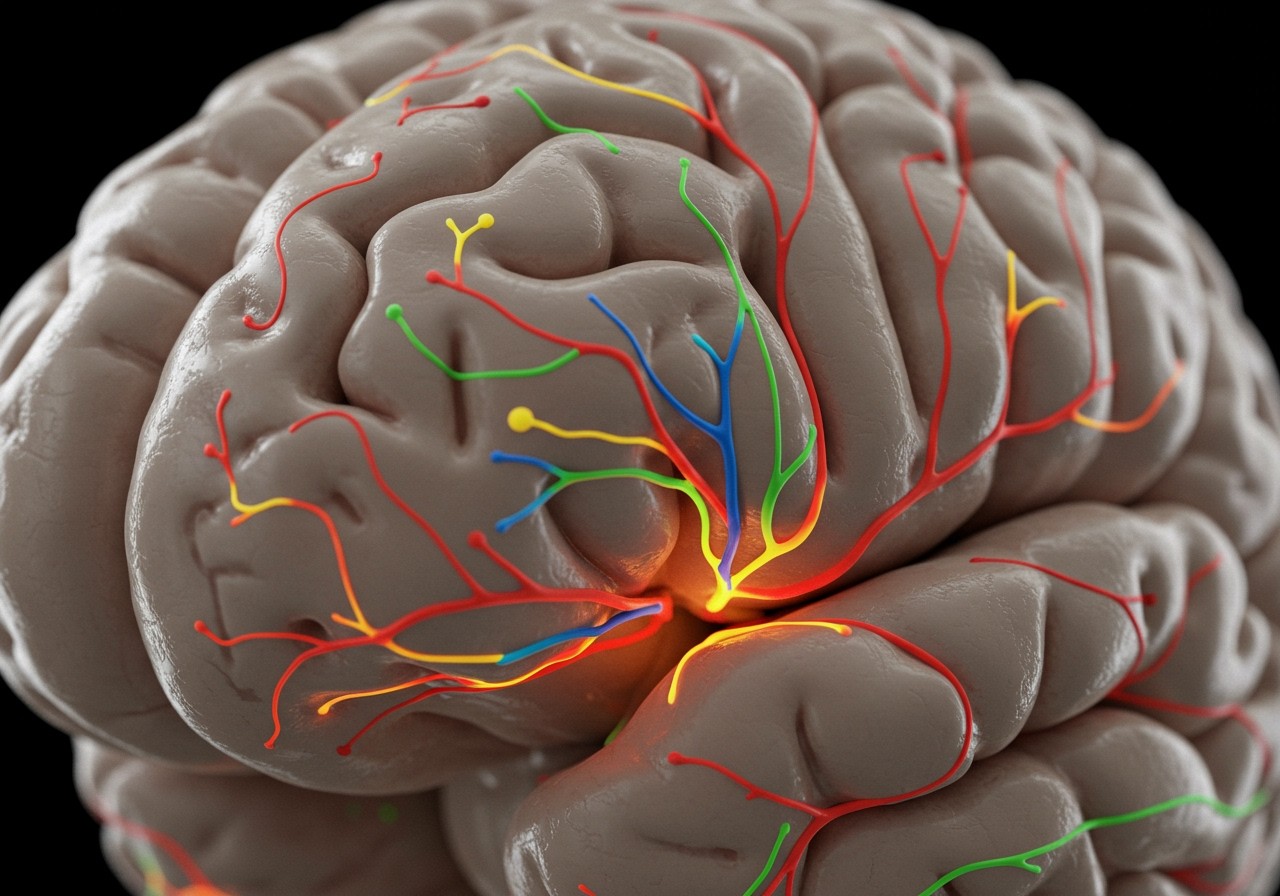
A morfin az agyra gyakorolt hatását elsősorban az opioid receptorokhoz való kötődése révén fejti ki. Ezek a receptorok, mint például a mű (μ), delta (δ) és kappa (κ) receptorok, elszórtan helyezkednek el az agy különböző területein, beleértve a fájdalomérzékelésben kulcsszerepet játszó agytörzset, gerincvelőt és a limbikus rendszert.
Amikor a morfin kötődik ezekhez a receptorokhoz, bonyolult biokémiai folyamatok indulnak be. Ezek a folyamatok csökkentik a fájdalomjelek továbbítását a perifériáról az agyba, és modulálják az agy fájdalomra adott válaszát. A morfin leginkább a mű-opioid receptorokhoz kötődik, ami a fájdalomcsillapító hatásának fő oka.
A morfin hatásmechanizmusának lényege, hogy az opioid receptorokhoz kötődve gátolja a fájdalomjelek továbbítását és megváltoztatja az agy fájdalomérzékelését, ami a fájdalomérzet csökkenéséhez vagy teljes megszűnéséhez vezet.
Ezen túlmenően, a morfin befolyásolja a dopamin felszabadulását az agy jutalmazó központjaiban. Ez a dopamin felszabadulás az, ami hozzájárul a morfin eufóriát okozó és addiktív hatásához. Fontos megjegyezni, hogy a morfin hatása nem csupán a fájdalomérzékelés blokkolására korlátozódik; befolyásolja a hangulatot, a légzést és más fontos élettani funkciókat is, ami magyarázza a mellékhatásait.
A fájdalomérzékelés neurobiológiája: Általános áttekintés
A fájdalomérzékelés egy komplex, többlépcsős folyamat, melynek során a perifériás idegvégződések által érzékelt nociceptív ingerek (pl. hő, nyomás, kémiai anyagok) az agyba jutnak, ahol tudatosul a fájdalomérzet. Ezek az ingerek elektromos jelekké alakulnak, melyek az idegrostokon keresztül a gerincvelőbe jutnak.
A gerincvelőben a fájdalomjelek átkapcsolódnak és továbbítódnak az agyba, elsősorban a talamuszba. A talamusz az ingerek szortírozásának és elosztásának központja, ahonnan a jelek az agykéreg különböző területeire kerülnek. Ezek a területek felelősek a fájdalom lokalizálásáért, intenzitásának megítéléséért és az érzelmi reakciókért.
Különböző agyterületek vesznek részt a fájdalom feldolgozásában, beleértve a szomatoszenzoros kérget (a fájdalom lokalizálása), az insula (a fájdalom érzelmi komponense), és az elülső cinguláris kérget (a fájdalom figyelmi és motivációs aspektusai). A fájdalomérzékelést befolyásolják a leszálló pályák is, melyek az agyból a gerincvelőbe futnak, és gátolhatják a fájdalomjelek továbbítását.
A fájdalomérzékelés nem pusztán egy passzív folyamat, hanem aktívan modulálható az agy által, mind gátló, mind serkentő mechanizmusok révén.
Fontos megjegyezni, hogy a fájdalomérzékelés szubjektív élmény, melyet számos tényező befolyásolhat, beleértve a genetikai hajlamot, a korábbi fájdalomélményeket, a pszichés állapotot és a társadalmi környezetet. Ez a komplexitás magyarázza, hogy miért reagálnak az emberek eltérően ugyanarra a fájdalomingerre.
A fájdalomcsillapítók, mint például a morfin, ezen a bonyolult rendszeren keresztül fejtik ki hatásukat, befolyásolva a fájdalomjelek továbbítását és feldolgozását az agyban és a gerincvelőben.
A nociceptorok szerepe a fájdalom jelátvitelében
A nociceptorok, avagy fájdalomérző idegvégződések kritikus szerepet játszanak a fájdalom jelátvitelében. Ezek a speciális receptorok a bőrben, izmokban, ízületekben és belső szervekben találhatók, és a káros ingerekre reagálnak. Ezek az ingerek lehetnek mechanikai (pl. nyomás, vágás), termikus (pl. hő, hideg) vagy kémiai (pl. gyulladásos anyagok) természetűek.
Amikor egy nociceptor aktiválódik, elektromos jelet generál, amit akciós potenciálnak nevezünk. Ez az akciós potenciál az idegrostokon keresztül a gerincvelőbe jut. A gerincvelőben a fájdalomjelek átkapcsolódnak a másodrendű idegsejtekre, amelyek az agyba továbbítják az információt.
A morfin és más opioidok a fájdalomcsillapító hatásukat többek között azáltal fejtik ki, hogy befolyásolják a nociceptorok aktivitását és a fájdalomjelek átvitelét a gerincvelőben. Ez azt jelenti, hogy közvetlenül a fájdalom érzékelésének forrásánál avatkoznak be.
A morfin elsősorban az opioid receptorokhoz kötődik, amelyek a nociceptorokon is megtalálhatók. Ez a kötődés csökkenti a nociceptorok érzékenységét a káros ingerekre, ezáltal csökkentve a generált akciós potenciálok számát. Továbbá, a morfin gátolja a kalcium csatornák működését a nociceptorokban, ami szintén hozzájárul a fájdalomjelek csökkenéséhez.
Fontos megjegyezni, hogy a nociceptorok csak az első lépést jelentik a fájdalom érzékelésében. Az agyban történő feldolgozás és a fájdalomérzet kialakulása sokkal komplexebb folyamat, amelyben számos agyi terület vesz részt. A morfin hatása nem korlátozódik a nociceptorokra; az agy különböző területein is befolyásolja a fájdalomérzékelést és a fájdalomhoz kapcsolódó érzelmi reakciókat.
A fájdalom útvonalai a perifériától az agyig
A fájdalom érzékelése egy komplex folyamat, amely a perifériás idegrendszerben kezdődik és az agyban ér véget. Amikor szövetkárosodás történik, például egy sérülés következtében, a perifériás idegvégződések, az úgynevezett nociceptorok aktiválódnak. Ezek a receptorok érzékelik a fájdalmat kiváltó ingereket, mint például a hő, a nyomás vagy a kémiai anyagok.
Az aktivált nociceptorok elektromos jeleket generálnak, amelyek az idegrostokon keresztül a gerincvelőbe jutnak. A gerincvelőben ezek a jelek átkapcsolódnak a második neuronra, amely az agytörzsbe és a thalamusba továbbítja az információt. A thalamus egyfajta reléállomásként működik, és az érzékszervi információkat az agy különböző területeire irányítja.
A thalamusból a fájdalomjelek az agykéreg különböző területeire jutnak, beleértve a szomatoszenzoros kérget (amely a fájdalom helyét és intenzitását dolgozza fel), az insulát (amely az érzelmi reakciókat szabályozza), és a cinguláris kérget (amely a fájdalommal kapcsolatos figyelmi folyamatokat befolyásolja). Ezek a területek együttesen alkotják a fájdalommátrixot, amely a fájdalomérzet tudatos megéléséért felelős.
A morfin befolyásolja ezt a fájdalom útvonalat. Főként az agyban és a gerincvelőben található opioid receptorokhoz kötődik. Ezek a receptorok természetes fájdalomcsillapító rendszerek részei, amelyek endorfinokat és enkefalinokat használnak. A morfin, mint egy külső opioid, utánozza ezeknek a természetes fájdalomcsillapítóknak a hatását.
A morfin kötődése az opioid receptorokhoz gátolja a fájdalomjelek továbbítását a gerincvelőben és az agyban, csökkentve ezzel a fájdalomérzetet.
Ezen felül, a morfin az agytörzsben található leszálló pályákat is aktiválja, amelyek a gerincvelőbe visszajutva tovább csökkentik a fájdalom továbbítását. Ez egyfajta „kapu” mechanizmusként működik, ahol a fájdalomjelek eljutása az agyba korlátozva van.
Fontos megjegyezni, hogy a morfin nem szünteti meg a fájdalom okát, csupán a fájdalomérzetet csökkenti. Ezen kívül, a morfin hosszan tartó használata tolerancia kialakulásához vezethet, ami azt jelenti, hogy egyre nagyobb dózisokra van szükség a kívánt fájdalomcsillapító hatás eléréséhez.
A morfin kémiai szerkezete és farmakokinetikája
A morfin egy komplex, pentaciklusos molekula, melynek kémiai szerkezete kulcsfontosságú a fájdalomcsillapító hatás szempontjából. A molekulában található hidroxil- és metoxilcsoportok befolyásolják a receptorokhoz való kötődést. A morfin felszívódása a gyomor-bélrendszerből változó, és jelentős első-passzázs metabolizmuson megy keresztül a májban, ami csökkenti a biohasznosulását. Ez azt jelenti, hogy csak egy része jut el változatlan formában a szisztémás keringésbe.
A morfin a vér-agy gáton átjutva éri el az agyat. A farmakokinetikája során fontos szempont a fehérjékhez való kötődése is, ami befolyásolja a szabad morfin koncentrációját a vérben, és ezáltal a hatékonyságát. A morfin metabolitjai között van a morfin-6-glükuronid (M6G), ami erősebb fájdalomcsillapító hatással rendelkezik, mint maga a morfin, míg a morfin-3-glükuronid (M3G) neuroexcitátor hatású lehet. A morfin és metabolitjai a vesén keresztül ürülnek ki.
A morfin fájdalomcsillapító hatása elsősorban az agyban és a gerincvelőben található μ-opioid receptorokhoz való kötődésen keresztül valósul meg.
A morfin fél életideje körülbelül 2-4 óra, ami befolyásolja a dózisolási intervallumokat. A farmakokinetikai paraméterek egyéni variabilitást mutatnak, melyet genetikai tényezők, életkor, máj- és vesefunkció is befolyásolhatnak.
Opioid receptorok: Típusok, eloszlás és funkciók
A morfin fájdalomcsillapító hatása elsősorban az opioid receptorokon keresztül valósul meg. Ezek a receptorok a központi idegrendszerben, de a perifériás idegrendszerben és a gyomor-bél traktusban is megtalálhatók. Három fő típusa ismert: a mű (μ), a kappa (κ) és a delta (δ) receptorok.
A mű (μ) receptorok felelősek a morfin legerősebb fájdalomcsillapító hatásáért, valamint az eufóriáért és a légzési depresszióért is. Magas koncentrációban találhatók az agy fájdalomérzékelő területein, mint például a periaqueductalis szürkeállomány (PAG) és a thalamus. Aktiválásuk gátolja a fájdalomimpulzusok továbbítását, ezáltal csökkentve a fájdalomérzetet.
A kappa (κ) receptorok szintén részt vesznek a fájdalomcsillapításban, de a mű receptorokhoz képest más mechanizmusokon keresztül. Aktiválásuk szedációt, diszfóriát (rossz hangulatot) és hallucinációkat okozhat. Kevésbé felelősek a légzési depresszióért, mint a mű receptorok. Eloszlásuk az agyban eltér a mű receptorokétól, nagyobb koncentrációban találhatók a gerincvelőben és a hypothalamusban.
A delta (δ) receptorok szerepe a fájdalomcsillapításban kevésbé tisztázott, de úgy tűnik, hogy szinergikusan működnek a mű receptorokkal. Befolyásolják a hangulatot, a stresszválaszt és a neuroplaszticitást is. Eloszlásuk hasonló a mű receptorokéhoz, de alacsonyabb koncentrációban vannak jelen.
A morfin a mű receptorokhoz kötődve fejti ki legerősebb hatását, gátolva a fájdalomimpulzusok továbbítását és eufóriát okozva.
Fontos megjegyezni, hogy az opioid receptorok különböző alcsoportjai is léteznek, amelyek eltérő farmakológiai profilokkal rendelkeznek. A morfin hatásai függenek attól, hogy melyik receptorhoz kötődik, és milyen mértékben aktiválja azt. A receptorok eloszlása és sűrűsége egyénenként is változhat, ami befolyásolja a morfinra adott választ.
Az opioid receptorok aktiválása nem csak a fájdalomcsillapításban játszik szerepet, hanem számos más élettani folyamatban is, beleértve a légzést, a szívműködést, a gyomor-bél motilitását és a hormonális szabályozást. Emiatt a morfin alkalmazása számos mellékhatással járhat.
A morfin kötődése az opioid receptorokhoz: Szelektivitás és affinitás
A morfin fájdalomcsillapító hatása az agyban található opioid receptorokhoz való kötődésén keresztül érvényesül. Ezek a receptorok (μ, δ, és κ) különböző agyi területeken találhatók meg, és mindegyikük más-más módon befolyásolja a fájdalomérzékelést és a kapcsolódó idegrendszeri folyamatokat.
A morfin szelektivitása azt jelenti, hogy bizonyos opioid receptorokhoz erősebben kötődik, mint másokhoz. Leginkább a μ (mű) receptorokhoz mutat affinitást, amelyek kulcsszerepet játszanak a fájdalomcsillapításban, eufóriában és légzésdepresszióban. Bár a morfin nem tökéletesen szelektív, a μ receptorokhoz való erőteljesebb kötődése magyarázza a legtöbb farmakológiai hatását.
Az affinitás a morfin és az opioid receptor közötti kötődés erősségét jelöli. Minél nagyobb az affinitás, annál kisebb koncentrációban van szükség a morfinból ahhoz, hogy a receptor telítődjön és kiváltsa a hatását. A morfin magas affinitást mutat a μ receptorokhoz, ami azt jelenti, hogy viszonylag kis mennyiség is elegendő lehet a fájdalom csillapításához.
Azonban a magas affinitás nem feltétlenül jelent nagyobb terápiás hatást, mivel a receptor egyéb tulajdonságai, mint például a jelátviteli hatékonyság is befolyásolják a végső választ.
A morfin kötődése az opioid receptorokhoz egy komplex folyamat, amelyet számos tényező befolyásol, beleértve a receptor alaptípusát, a receptor környezetét és a beteg egyéni genetikai adottságait. Ez a komplexitás magyarázza, hogy miért reagálnak különbözőképpen az emberek a morfinra.
Intracelluláris jelátviteli útvonalak: A morfin hatása a neuronális aktivitásra
A morfin hatása az agyra komplex intracelluláris jelátviteli útvonalakon keresztül valósul meg, elsősorban az opioid receptorok aktiválásán keresztül. Ezek a receptorok, mint például a μ (mű)-opioid receptor (MOR), a δ (delta)-opioid receptor (DOR) és a κ (kappa)-opioid receptor (KOR), G-fehérjéhez kapcsolt receptorok (GPCR-ek).
Amikor a morfin kötődik egy opioid receptorhoz, a G-fehérje aktiválódik. Ez a folyamat számos másodlagos hírvivő molekulát érint, melyek befolyásolják a neuronális aktivitást. Például, a MOR aktiválása gátolja az adenilát-cikláz enzim működését, ami csökkenti a ciklikus AMP (cAMP) szintjét a neuronban. Ez a cAMP-szint csökkenése befolyásolja a protein kináz A (PKA) aktivitását, ami fontos szerepet játszik a neuronális jelátvitelben.
Ezenkívül az opioid receptorok aktiválása közvetlenül befolyásolja az ioncsatornák működését. A MOR aktiválása például növeli a kálium (K+) csatornák áteresztőképességét, ami hiperpolarizálja a neuron membránját, ezáltal csökkentve annak ingerlékenységét. Ezzel párhuzamosan csökkenti a kalcium (Ca2+) csatornák áteresztőképességét, ami szintén csökkenti a neuronális aktivitást. Mindezek a hatások együttesen vezetnek a fájdalomérzékelés csökkenéséhez.
A morfin által kiváltott fájdalomcsillapító hatás alapja tehát a neuronális ingerlékenység csökkentése a gerincvelőben és az agyban, amit az opioid receptorok aktiválása és az intracelluláris jelátviteli útvonalak befolyásolása idéz elő.
Fontos megjegyezni, hogy a morfin tartós használata adaptációs mechanizmusokat indíthat el a neuronokban, ami tolerancia és függőség kialakulásához vezethet. Ezek az adaptációk a receptorok számának változásában (le- vagy felszabályozás), a jelátviteli útvonalak módosulásában és más kompenzációs mechanizmusokban nyilvánulhatnak meg.
A morfin hatása a fájdalomcsillapításra: A gerincvelői szintű gátlás
A morfin fájdalomcsillapító hatásának egyik kulcsfontosságú mechanizmusa a gerincvelői szintű gátlás. Ez azt jelenti, hogy a morfin nem csak az agyban fejti ki hatását, hanem már a gerincvelőben is befolyásolja a fájdalomjelek továbbítását.
A gerincvelőben találhatóak az első szinapszisok, ahol a perifériáról (pl. sérült szövetekből) érkező fájdalomjelek áttevődnek a központi idegrendszerbe, az agy felé. A morfin opioid receptorokhoz kötődik a gerincvelő hátsó szarvában, elsősorban a substantia gelatinosa területén. Ezek a receptorok aktiválódva gátolják a fájdalomjeleket közvetítő neuronok aktivitását.
Ez a gátlás többféle módon valósul meg. Egyrészt, a morfin csökkenti a fájdalomjeleket közvetítő neuronokból felszabaduló neurotranszmitterek (pl. glutamát, substance P) mennyiségét. Másrészt, hiperpolarizálja a posztszinaptikus neuronokat, ami nehezebbé teszi számukra a fájdalomjel továbbítását.
A morfin tehát a gerincvelőben „zárja le a kaput” a fájdalomjelek előtt, megakadályozva, hogy azok teljes intenzitásukban eljussanak az agyba.
Fontos megjegyezni, hogy a gerincvelői gátlás nem az egyetlen mechanizmus, amellyel a morfin fájdalmat csillapít. Az agyban is számos területen hat, befolyásolva a fájdalomérzékelés emocionális és kognitív aspektusait is. Mindazonáltal a gerincvelői szintű gátlás kiemelkedő jelentőségű, hiszen már a fájdalomjel út elején képes csökkenteni annak intenzitását.
Szupraszpinális hatások: A morfin szerepe az agytörzs és a kéreg modulációjában
A morfin nem csak a gerincvelőben fejti ki hatását; jelentős szerepe van az agytörzs és a kéreg modulációjában is. Ezeket a hatásokat szupraszpinális hatásoknak nevezzük. Az agytörzsben a morfin befolyásolja a periaqueductalis szürkeállományt (PAG), egy kulcsfontosságú területet, mely a fájdalomcsillapítás központi irányítója.
A PAG aktiválása egy bonyolult, leszálló pályát indít el, mely eléri a gerincvelőt és gátolja a fájdalomjelek továbbítását. Ezen kívül, a morfin az agytörzs más területein, például a nucleus raphe magnus-ban és a locus coeruleus-ban is hat, melyek szintén részt vesznek a fájdalom modulációjában. Ezek a területek neurotranszmittereket, például szerotonint és noradrenalint szabadítanak fel, amelyek tovább csökkentik a fájdalomérzékelést.
A kéreg szintjén a morfin befolyásolja a fájdalomérzékelés kognitív és emocionális aspektusait. Bár a pontos mechanizmusok még nem teljesen tisztázottak, a morfin hatással van azokra a területekre, amelyek a fájdalomhoz kapcsolódó kellemetlenség, szorongás és félelem feldolgozásáért felelősek. Ez magyarázza, hogy a morfin miért nem csak a fájdalom intenzitását csökkenti, hanem a fájdalomhoz kapcsolódó szenvedést is.
A morfin legfontosabb szupraszpinális hatása a periaqueductalis szürkeállomány (PAG) aktiválása, ami egy leszálló fájdalomcsillapító pályát indít el, gátolva a fájdalomjelek gerincvelői továbbítását.
Fontos megjegyezni, hogy a morfin ezen hatásai komplexek és egyénenként változóak lehetnek. A genetikai tényezők, a korábbi fájdalomélmények és a pszichés állapot is befolyásolhatják, hogy a morfin hogyan hat az agyra és a fájdalomérzékelésre.
A jutalomközpont aktiválása: A morfin addiktív potenciálja
A morfin nem csupán a fájdalomérzékelést befolyásolja, hanem az agy jutalomközpontját is aktiválja, ami kulcsszerepet játszik a függőség kialakulásában. Ez a központ, mely a nucleus accumbens néven is ismert, a dopamin nevű neurotranszmitter felszabadulásával válaszol az örömteli ingerekre, például az evésre, szexre, vagy éppen a kábítószerekre.
A morfin közvetlenül és közvetetten is serkenti a dopamin felszabadulását. Kötődik az opioid receptorokhoz, melyek nem csak a fájdalomcsillapításban játszanak szerepet, hanem a jutalomközpont idegsejtjein is megtalálhatók. A morfin kötődése gátolja azokat a gátló idegsejteket (GABAerg neuronokat), amelyek normál esetben a dopaminerg neuronok aktivitását fékezik. Ennek eredményeként a dopaminerg neuronok szabadabban tüzelnek, és nagyobb mennyiségű dopamint szabadítanak fel.
Ez a dopamin-túladagolás intenzív eufóriát, vagyis „high” érzést okoz, ami rendkívül kellemes a használó számára. Az agy gyorsan megtanulja ezt az összefüggést: morfin = öröm. Minél többször ismétlődik ez a folyamat, annál erősebb lesz ez az asszociáció.
A morfin addiktív potenciálja abban rejlik, hogy az általa kiváltott eufória sokkal erősebb és gyorsabban elérhető, mint a természetes jutalmak által kiváltott érzés, így az agy „megtanulja” a morfint preferálni.
Az ismételt használat következtében az agy alkalmazkodik a morfin jelenlétéhez. A dopamin receptorok érzékenysége csökkenhet (downregulation), ami azt jelenti, hogy egyre nagyobb adag morfinra van szükség ahhoz, hogy ugyanazt az eufóriát elérje a használó. Ezt nevezzük toleranciának. Ha a morfin hirtelen elvonásra kerül, az agy nem képes azonnal visszaállni a normál dopamin-szintre, ami megvonási tünetekhez vezet (pl. szorongás, izzadás, hányinger).
A tolerancia és a megvonási tünetek együttesen erősítik a kényszert a morfin használatára, így alakul ki a függőség.
A tolerancia és függőség kialakulásának neurobiológiai alapjai
A morfin hosszú távú használata tolerancia és függőség kialakulásához vezethet. Ennek hátterében komplex neurobiológiai folyamatok állnak. A tolerancia azt jelenti, hogy ugyanazon fájdalomcsillapító hatás eléréséhez egyre nagyobb dózisra van szükség, mivel az agy hozzászokik a morfin jelenlétéhez.
A morfin az agy opioid receptoraihoz kötődve fejti ki hatását. Hosszan tartó morfinhasználat esetén az agy kompenzációs mechanizmusokat indít be. Ezek a mechanizmusok magukban foglalhatják a receptorok számának csökkenését (downregulation), a receptorok érzékenységének csökkenését (deszenzitizáció), valamint a jelátviteli útvonalak megváltozását.
Például, a morfin gátolja a GABAerg neuronokat, amelyek a dopaminerg neuronokat gátolják. Ennek következtében a dopaminerg neuronok felszabadulnak a gátlás alól, és több dopamint termelnek. Ez a dopamin-felszabadulás okozza a morfin eufóriás hatását. Hosszan tartó használat esetén az agy hozzászokik ehhez a megnövekedett dopamin-szinthez, és a normál dopamin-szintek már nem elegendőek a jó közérzet fenntartásához. Ez vezet a megvonási tünetekhez, ha a morfin használatát hirtelen abbahagyják.
A függőség kialakulásában kulcsszerepet játszik az agy jutalmazó rendszere, különösen a nucleus accumbens. A morfin aktiválja ezt a rendszert, ami megerősíti a gyógyszerhasználó viselkedést. Az ismételt morfinhasználat strukturális és funkcionális változásokat okozhat az agyban, amelyek megnehezítik a gyógyszerhasználat kontrollálását.
A tolerancia és függőség kialakulásában genetikai tényezők is szerepet játszhatnak. Egyes emberek genetikailag fogékonyabbak lehetnek a morfin függőséget okozó hatásaira, mint mások. Ezenkívül a környezeti tényezők, például a stressz és a traumatikus élmények is növelhetik a függőség kockázatát.
A morfinhasználat abbahagyása után a megvonási tünetek jelentkezhetnek, amelyek közé tartozhatnak a szorongás, izomfájdalmak, hányinger, hányás, hasmenés és izzadás. Ezek a tünetek a morfin hirtelen hiányának következményei, és az agy próbálja helyreállítani a normális működését.
A morfin mellékhatásai: Légzésdepresszió, székrekedés és hányinger
A morfin, bár hatékony fájdalomcsillapító, sajnos számos mellékhatással is járhat. Ezek közül a légzésdepresszió, a székrekedés és a hányinger különösen gyakoriak és fontosak. A morfin az agyban található opioid receptorokhoz kötődik, nem csupán a fájdalomközpontokban, hanem azokban a területeken is, amelyek a légzés, a bélműködés és a hányinger szabályozásáért felelősek.
A légzésdepresszió a morfin egyik legveszélyesebb mellékhatása. A morfin csökkenti a légzőközpont érzékenységét a vérben lévő szén-dioxidra, ami lelassult és felületes légzéshez, súlyos esetben légzésleálláshoz vezethet. Ezért a morfin alkalmazásakor a légzést szigorúan ellenőrizni kell, különösen idős betegeknél és légzőszervi problémákkal küzdőknél.
A székrekedés a morfin által kiváltott másik gyakori probléma. A morfin lelassítja a bélmozgást, mert az opioid receptorok a bélfalban is megtalálhatók. Ez azt jelenti, hogy a táplálék és a salakanyagok lassabban haladnak át a bélrendszeren, több víz szívódik fel, ami kemény széklethez és nehéz székeléshez vezet. A székrekedés megelőzése érdekében fontos a megfelelő folyadékbevitel és a rostban gazdag étrend.
A hányinger és hányás szintén gyakori mellékhatások, különösen a morfin kezelés kezdetén. A morfin stimulálja az agytörzsben található hányásközpontot, ami émelygéshez és hányáshoz vezethet. Ezt a mellékhatást gyakran antiemetikumokkal (hányingercsökkentő gyógyszerekkel) kezelik.
A morfin hatása a légzésre, bélműködésre és hányingerre a központi idegrendszerben lévő opioid receptorokhoz való kötődéséből adódik, ami nem csupán a fájdalomcsillapítást, hanem ezeket a nem kívánt mellékhatásokat is okozza.
Fontos megjegyezni, hogy a mellékhatások mértéke egyénenként változó lehet, és függ a morfin dózisától, a beteg általános állapotától és más gyógyszerek egyidejű szedésétől. Ezért a morfin alkalmazása mindig orvosi felügyeletet igényel.
A morfin alternatívái a fájdalom kezelésében
Bár a morfin hatékony fájdalomcsillapító, számos alternatíva létezik a fájdalom kezelésére, melyek kevésbé kockázatosak vagy specifikusabbak lehetnek az adott fájdalom típusára. Ezek az alternatívák a fájdalomérzékelés különböző pontjain avatkoznak be, így elkerülhető a morfin agyra gyakorolt közvetlen hatása.
Ilyen alternatívák például a nem-szteroid gyulladáscsökkentők (NSAID-ok), mint az ibuprofen vagy a naproxen, melyek a gyulladás csökkentésével enyhítik a fájdalmat. Ezek főleg enyhe és közepes fájdalom esetén hatásosak. A paracetamol egy másik gyakran használt fájdalomcsillapító, melynek hatásmechanizmusa nem teljesen tisztázott, de valószínűleg a központi idegrendszerben fejti ki hatását.
A neuropátiás fájdalom kezelésére speciális gyógyszerek állnak rendelkezésre, mint például a gabapentin vagy a pregabalin, melyek az idegsejtek ingerlékenységét csökkentik. A triciklusos antidepresszánsok is alkalmazhatók krónikus fájdalom kezelésére, bár mechanizmusuk nem teljesen tisztázott a fájdalomcsillapítás terén.
A nem-gyógyszeres módszerek, mint a fizioterápia, a pszichoterápia, az akupunktúra, a masszázs, szintén fontos szerepet játszhatnak a fájdalom kezelésében, különösen a krónikus fájdalom esetén.
Súlyos fájdalom esetén, ha az opioidok elkerülhetetlenek, más opioidok is szóba jöhetnek, mint a kodein, tramadol vagy oxikodon, melyek más hatékonyságúak és mellékhatás profilúak.
Fontos megjegyezni, hogy a fájdalom kezelése mindig egyénre szabott kell, hogy legyen, figyelembe véve a fájdalom okát, intenzitását és a páciens általános egészségi állapotát.